《Nature》重磅!诱导滋养层干细胞有望帮助治疗孕期胎盘并发症!
近日,一项刊登在国际杂志《Nature》上的研究报告中,澳大利亚莫纳什大学和杜克-努斯大学的研究人员进行了一项国际合作,研究取得了世界上首个令人意想不到的干细胞发现,相关研究结果或有望帮助治疗女性孕期胎盘并发症的新型疗法。
什么是孕期胎盘并发症?
“胎盘(placenta),是胎儿与母体之间物质交换的重要器官,是人类妊娠期间由胚胎胚膜和母体子宫内膜联合长成的母子间组织结合器官。作为重要的营养传输、废物代谢的枢纽,起着非常重要的作用。在孕期产检中,会定期做B超检测,定期观测胎盘及宝宝情况。而胎盘的状况就决定了母婴的状况。
胎盘的异常状况,一般多发生于孕中期到孕晚期。孕期胎盘主要有两种比较严重的并发症:前置胎盘和胎盘早剥。
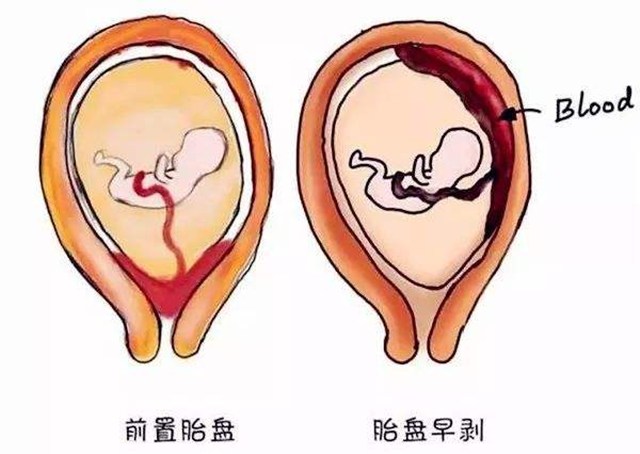
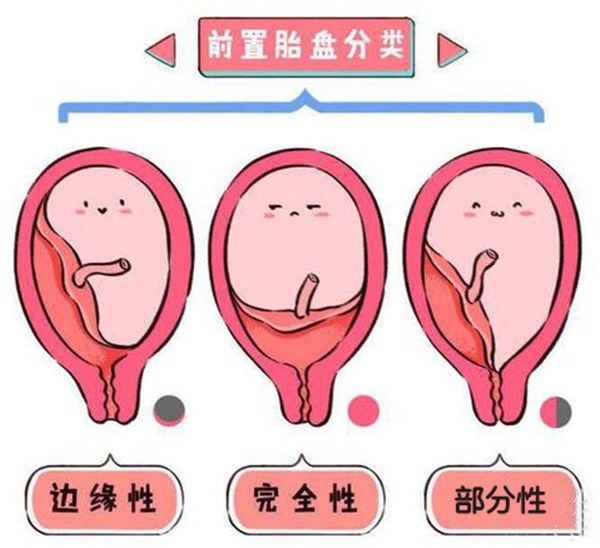
前置胎盘是指妊娠28周后,胎盘附着于子宫下段,甚至胎盘下缘达到或覆盖宫颈内口,其位置低于胎先露部。前置胎盘是妊娠晚期出血的主要原因之一,是妊娠期晚期的严重并发症,多见于经产妇,尤其是多产妇。前置胎盘孕妇死亡率在国内报道为0.2%-1.5%,国外报道为0.5%,前置胎盘的患者中,85%-95%为经产妇,尤其是多产妇,发生率可以高达5%。
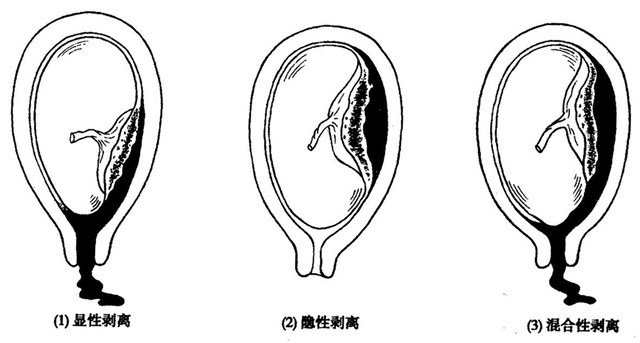
胎盘早剥是指妊娠20周后或分娩期,正常位置的胎盘在胎儿娩出前,部分或全部从子宫壁剥离的现象,属于一种妊娠晚期的严重并发症,具有起病急、发展快的特点。如果没有及时发现并采取措施,严重的甚至会威胁到母婴的生命。国内报道胎盘早剥发生率0.46%-2.10%,围生儿死亡率为20%-35%,是无胎盘早剥的15倍;国外报道发生率约1%,围生儿死亡率约为15% 。但是如果产后经由病理医生检查胎盘而进行诊断,发病率则高达2.12%-3.80%。
在孕晚期,准妈妈需要多注意宝宝的异常胎动情况,如果出现「腹痛+其他异常症状」,如呕吐、胎动异常、见红,最好尽快到医院检查,确保胎儿是否安全。
诱导滋养层干细胞有望治疗孕期胎盘并发症
科学家们都知道,成人机体的皮肤细胞能被重编程为类似于人类胚胎干细胞的细胞,随后其能被用来发育来自人类器官的组织,即诱导多能干细胞(iPSCs),但同样的过程却不能生成胎盘组织;
iPSCs开启了个体化细胞疗法的潜力,并能为再生医学、安全药物测试和毒性评估提供新的思路和机会,然而研究人员对于如何制造iPSCs知之甚少。
莫纳什大学Jose M. Polo研究团队利用重编程路线图揭示了人类诱导滋养层干细胞的生成途径。在本研究中,为了解决重编程分子机制的问题,研究人员利用单细胞转录组学重现了人皮肤成纤维细胞的分子重编程轨迹。研究表明,重编程为初始和原始多能干细胞遵循着截然不同的轨迹。
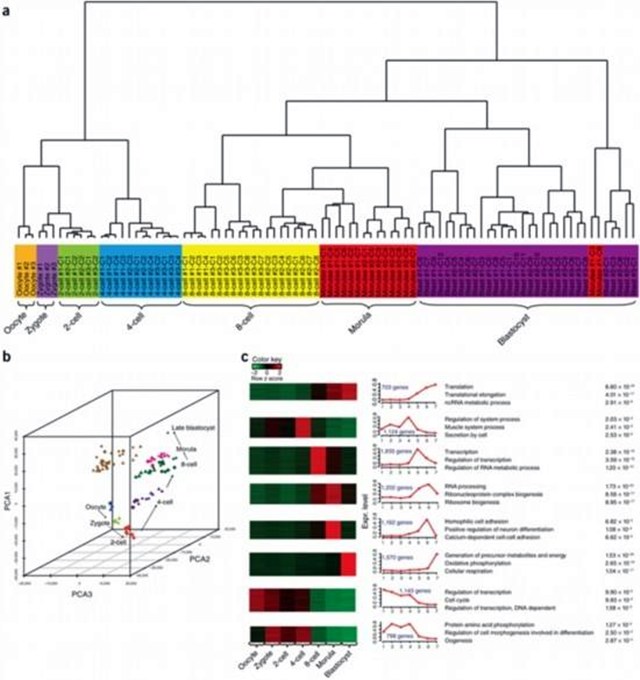
这项研究中,研究人员通过联合研究分析了终将会转变成为iPSCs的成体皮肤细胞所发生的分子改变,此外在研究过程中,研究人员还发现了一种新方法,这种类似于滋养外胚层的状态可以被观察到,其能够帮助制造诱导滋养层干细胞(iTSCs,induced trophoblast stem cells),诱导的滋养层干细胞在分子和功能上类似于人胚泡或早孕胎盘的滋养层干细胞,从而就能被用来制造胎盘细胞。
该研究结果为转录因子介导的人体细胞重编程提供了高分辨率路线图,表明了滋养外胚层谱系特异性调控程序在此过程中的作用,并促进了体细胞直接重编程为诱导滋养层干细胞的发展。研究者Polo表示,该研究结果非常重要,因为iPSCs并不能产生胎盘,因此在疾病建模和iPSCs所带来的细胞治疗方面的进展似乎并不能转化到胎盘研究上;研究人员的目的是了解iPSCs形成的具体细节,然而在研究过程中他们发现了iTSCs,这一研究发现或能帮助后期在体外模拟人类胎盘并进一步开发新型的细胞疗法。
什么是滋养层干细胞?
滋养层(Trophoblast)位于囊胚的最外层,提供胚胎营养,最后大部分会形成胎盘。滋养层在怀孕的第一阶段就会形成,也是受精卵第一个群分化的细胞。在原肠形成后,滋养层被称作滋养外胚层,因为这时它与胚胎外胚层相连在一起。——中文维基
在胚胎发育成桑椹胚后,桑椹胚进一步发育,细胞开始出现分化。聚集在胚胎的一端,个体较大的细胞,称为内细胞团(inner cell mass,ICM),内细胞团的细胞是胚胎干细胞是一种未分化的细胞,具有发育全能性,将来发育成胎儿的各种组织,而沿透明带内壁扩展和排列的,个体较小的细胞,称为滋养层细胞,它们将来发育成胎膜和胎盘。——百度百科

滋养层干细胞(TSC)是一种来源于囊胚中滋养外胚层的细胞,与来源于囊胚内细胞团的胚胎多能干细胞(ESC)相对应。滋养层干细胞在后续发育过程中能分化为组成胎盘的各种滋养细胞,是一种研究胎盘发育调控分子机制很好的体外细胞模型。
诱导滋养层干细胞iTSCs研究进展
来自北京生命科学研究所的研究人员于2011年2月8日在《干细胞》(Stem Cells )杂志上发表了题为“Reprogramming of trophoblast stem cells into pluripotent stem cells by Oct4”的新研究文章。该文章首次报道了一个转录因子Oct4可以将滋养外胚层来源的滋养层干细胞重编程为具有分化为三胚层能力的多潜能干细胞。
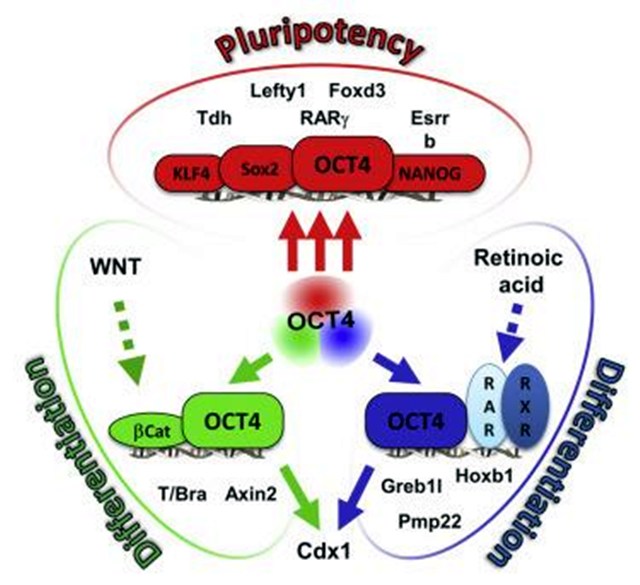
2017年11月16日,国际著名学术杂志《Cell》子刊《Stem Cell Reports》杂志在线发表了中国科学院遗传与发育生物学研究所张建研究组的一篇研究论文,论文报道了滋养层干细胞定向分化和胎盘细胞发育研究新进展,研究发现激活Wnt信号通路可以将TS细胞在体外高效定向分化成均一的滋养层合包体II(SynT-II)细胞,并抑制胎盘类型细胞分化。该研究为在体外进一步研究滋养层合包体II(SynT-II)细胞以及胎盘发育打下了基础。

2018年11月20日,同济大学生命科学与技术学院高绍荣教授课题组在《Journal of Molecular Cell Biology》上在线发表题为“Esrrb plays important roles in maintaining selfrenewal of trophoblast stem cells (TSCs) and reprogramming somatic cells to induced TSCs”的文章。该研究揭示了Esrrb在滋养层干细胞维持及自我更新中的重要作用以及对小鼠成纤维细胞向诱导型滋养层干细胞重编程过程的促进作用。
2019年2月14日,南开大学药物化学生物学国家重点实验室率领研究团队利用可诱导过表达转录因子方式,首次在体外获得胎盘单倍体滋养层干细胞,它只有一套基因组,可在体外无限增殖并具备分化成胎盘谱系各种细胞潜能。该研究找到了生命树的成长“钥匙”,为基因筛查,胎盘发育、功能分析及胎盘疾病致病机制研究提供了理想体外模型,相关成果也以长文形式在细胞出版社旗下最新一期《整合科学》杂志发表。
展望
滋养层干细胞对胚胎附植、胚胎存活和胎盘发育起关键作用,是研究胎盘发育和功能的理想体外模型。目前,国内外对滋养层干细胞的研究处于方兴末艾之势,已经建立了以鼠为代表的小动物滋养层干细胞培养体系,对人的滋养层干细胞分离培养也取得一些进展。
经诱导的滋养层干细胞在分子和功能上类似于人胚泡或早孕胎盘的滋养层干细胞,可以被用来制造胎盘细胞。基于本文研究结果,后期科学家们将会继续深入研究开发治疗胎盘并发症的新型疗法,同时测定药物对胎盘细胞的毒性影响,这对于女性怀孕至关重要。
