国内肿瘤免疫细胞疗法大热?来看看相关政策
肿瘤免疫疗法近年大热,数据显示,2012年至今,全球已有超过25个研究中心证实,免疫疗法中最为大众所熟知的CAR-T疗法对白血病、淋巴瘤等颇为有效。近几年,作为人类攻克肿瘤征途中的重要突破点之一的免疫细胞疗法发展迅速,给人类抗癌史添加了一个又一个的里程碑成果,也确实为一些疑难疾病的治疗带来了新的希望。与技术发展相呼应的,一方面是免疫细胞治疗领域广受资本追捧,另一方面国家对该领域的政策和监管也在不断完善。
一般来说,肿瘤的治疗模式有两种,一是细胞杀伤,二是细胞调节。传统手术、化疗、放疗等治疗方法属于前者,对病人的身体存在一定的伤害;后者以提高机体的生物反应能力(包括免疫能力)为目的,控制肿瘤发展,对病人的损伤较小,免疫细胞疗法就是其中之一。
细胞免疫治疗疗法,是采集人体自身免疫细胞,经过体外培养,使其数量成千倍增多,靶向性杀伤功能增强,然后再回输到人体来杀灭血液及组织中的病原体、癌细胞、突变的细胞,打破免疫耐受,激活和增强机体的免疫能力,兼顾治疗和保健的双重功效。细胞因子诱导的杀伤细胞(CIK)疗法、树突状细胞(DC)疗法、API生物免疫治疗、DC+CIK细胞疗法、自然杀伤细胞(NK)疗法、DC-T细胞疗法等。
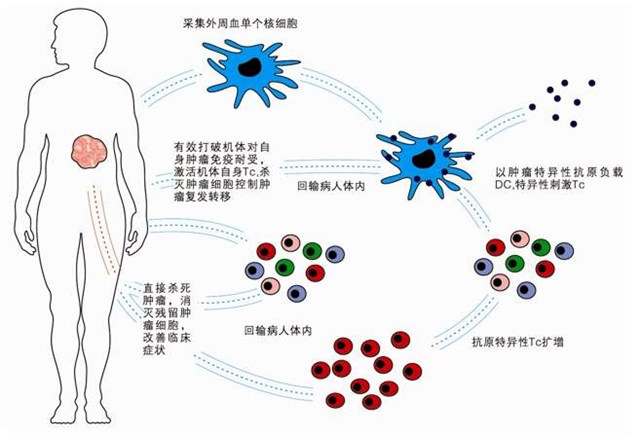
免疫细胞疗法的思路大致分为两种:一种是把肿瘤的特征“告诉”免疫细胞,让它们去搜寻、杀伤;另一种能让免疫细胞不被肿瘤麻痹,继续攻击肿瘤细胞。第一种思路的代表是目前融资市场比较热的CAR-T疗法。第二种思路的代表是PD-1抗体药物。这种药物能阻断肿瘤细胞对T细胞的“欺骗”,让T细胞恢复对肿瘤细胞的杀伤力。
纵观国内细胞治疗的发展历史,不难发现,细胞治疗领域的融资从2014年左右开始起步,2016年5月,滑膜肉瘤患者魏某事件后,原国家卫生计生委(下称“国家卫计委”)紧急叫停免疫细胞疗法临床应用,投融资市场热度受到了较大影响。

此后,直到2018年的诺贝尔生理学或医学奖授予了肿瘤免疫疗法研究者,免疫联合化疗首次在小细胞肺癌中获得成功,再到国家药品监督管理局(下称“国家药监局”)批准了进口免疫治疗药物“O药”和“K药”上市,国内细胞治疗企业投资额才再次出现急剧增长,一直到2019年,肿瘤免疫细胞治疗领域投融资热度持续。截至2020年4月,国内细胞治疗企业累计发生投资90余项,总融资额达73.5亿元。
根据弗若斯特沙利文报告,中国的细胞免疫治疗产品市场规模预计于2021年至2023年将由人民币13亿元增至人民币102亿元,随着更多细胞免疫治疗产品获批,市场预计于2030年可达人民币584亿元。
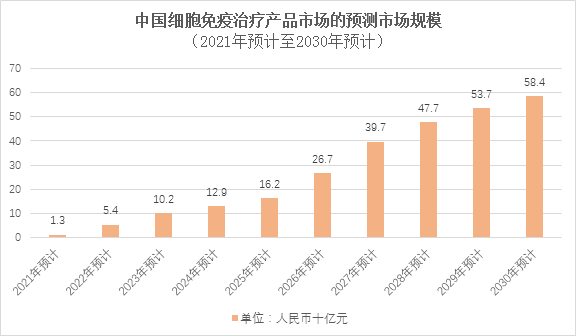
注:2021年预计至2023年预计复合年增长率181.5%;2023年预计至2030年预计复合年增长率28.3%。
除技术本身的发展外,免疫细胞治疗技术一直是政策及监管敏感的行业,政策及监管的变化对免疫细胞治疗领域投融资业务具有重大影响。
不同国家对免疫细胞治疗产品和技术的监管方式各有不同,但总体分为两条途径,一种是作为产品,由药品监管部门进行临床准入监管审批;另一种方式则将其作为一种医疗技术, 由卫生部门进行监管,医疗机构可依法自行决定临床应用。我国采取了“双轨制”监管方式,即免疫细胞疗法既可通过医学产品的形式独立于药物、医疗器械由国家药监局监管,也可以作为医疗技术由国家卫健委进行监管,以确保其安全有效性。
免疫细胞治疗技术的政策监管
免疫细胞治疗技术方面,我们经历了监管空白、准入审批、限制在临床研究领域三个阶段。
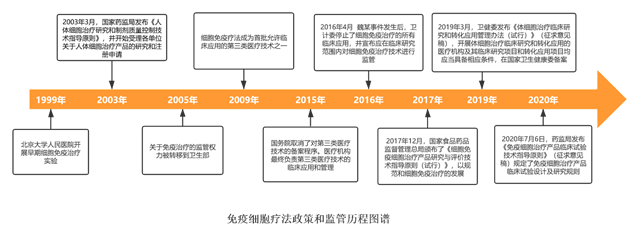
1.准入审批(2009年3月-2015年6月)
2009年3月2日,原国家卫生部颁布《医疗技术临床应用管理办法》(文号:卫医药发[2009]18号)(下称“2009《临床应用管理办法》”),明确规定我国建立医疗技术临床应用准入和管理制度,对医疗技术实行分类、分级管理。
2009年5月22日,原国家卫生部发布了《首批允许临床应用的第三类医疗技术目录》,免疫细胞治疗技术因其“涉及重大伦理问题,安全性、有效性尚需经规范的临床试验研究进一步验证”被列为第三类医疗技术。依据2009《临床应用管理办法》,第三类医疗技术首次临床应用前需经历申请、审核、审定、登记四个阶段。

实际上,根据原国家卫计委2018年1月4日在其官网发布的“关于政协十二届全国委员会第五次会议第0543号(医疗体育类056号)提案答复的函”,由于申报的医疗机构缺乏科学规范的临床研究结论和循证依据支持,截至2018年1月4日,原国家卫计委并未批准任何医疗机构开展该技术的临床应用。
2.限制于临床研究(2015年6月至今)
2015年6月29日,原国家卫计委发布了《关于取消第三类医疗技术临床应用准入审批有关工作的通知》及《限制临床应用的医疗技术(2015版)》。依据上述规定:“未在上述名单内的《首批允许临床应用的第三类医疗技术目录》其他在列技术,按照临床研究的相关规定执行。”细胞免疫治疗技术在列于《首批允许临床应用的第三类医疗技术目录》,而未列于《限制临床应用的医疗技术(2015)》,属于上述“其他在列技术”,故只能限定于临床研究,而不得进入临床应用。
简而言之,以免疫细胞疗法为主业的企业,其无资格独立进行临床研究,更无法将其享有的细胞疗法技术独立进行临床应用或商业化。该类企业可以与医疗卫生机构合作进行临床研究,在临床研究过程中提供细胞培养等技术服务。
2016年5月4日,国家卫计委召开了关于规范医疗机构科室管理和医疗技术管理工作的电视电话会议,重申了上述观点。会议称,未在《限制临床应用的医疗技术(2015版)》名单内的《首批允许临床应用的第三类医疗技术目录》其他在列技术(主要指自体免疫细胞治疗技术等),按照临床研究的相关规定执行。国家卫计委紧急叫停免疫细胞疗法临床应用,许多原本进行细胞免疫治疗的肿瘤患者,也只能被紧急叫停。
2019年3月29日,国家卫健委发布《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿),依据该管理办法征求意见稿,开展体细胞治疗临床研究和转化应用的医疗机构及其临床研究项目和转化应用项目均应当具备相应条件,在国家卫健委备案,并在备案项目范围内开展体细胞治疗临床研究和转化应用。该管理办法如果落地,意味着紧急叫停的免疫细胞治疗技术,或有存在放开的可能性。
免疫细胞治疗产品的政策监管
1999年5月26日,国家药监局出台了《新生物制品审批办法》,并在2002年10月30日发布的《药品注册管理办法》(试行)中正式将体细胞治疗及其制品列为生物制品类别,历经修订,该分类一直沿用至今。因此,国家药监局对于体细胞产品上市途径的态度始终未变,即按照生物制品申报。
2003年3月20日,原国家食药监局发布《人体细胞治疗研究和制剂质量控制技术指导原则》,并开始受理各单位关于人体细胞治疗产品的研究和注册申请。
为打开细胞治疗相关研究和产品的出路,2017年12月18日,原国家食药监局发布《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品按照药品管理相关法规进行研发时的技术要求进行了总体阐述。该指导原则重新启动细胞治疗产品的研究和注册申请,并对拟作为药品进行产品化、产业化生产的细胞治疗产品所需具备的条件作出详细规定,符合相关规定的产品即可上市。
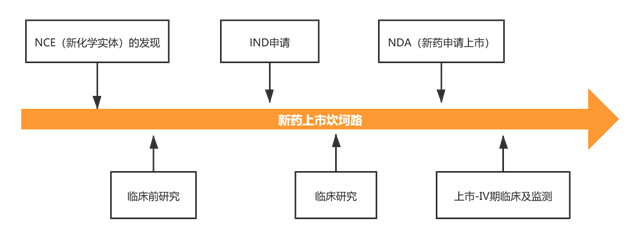
2019年1月4日,国家卫健委在“对十三届全国人大一次会议第6238号建议的答复”中也体现了我国对免疫细胞疗法的“双轨制”监管。即由国家卫健委对医疗机构自行研发制备并在医疗机构内开展的体细胞治疗进行监管,对按照药品生产的体细胞制剂依照原国家药监局发布的《细胞制品研究与评价技术指导原则(试行)》申请临床试验和上市许可。
2020年7月6日,国家药监局药品审评中心发布关于公开征求《免疫细胞治疗产品临床试验技术指导原则》(征求意见稿)意见的通知,该征求意见稿规定了免疫细胞治疗产品临床试验设计及研究规则,以期为药品研发注册申请人及开展药物临床试验的研究提供更具针对性的建议和指南。
2020年9月30日,国家药品监督管理局药品审评中心(CDE)发布公开征求《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》,以推动细胞治疗行业进一步规范化发展。
综上所述,我国对免疫细胞治疗实施“双轨制”监管,但鉴于自2015年起监管部门将免疫细胞治疗技术限定在临床研究领域而不允许临床应用,生物医药企业将细胞免疫治疗技术转化为生物制品,并通过国家药监局审查后上市是目前可合法合规将免疫细胞治疗商业化的现实出路。
无论是投资者还是企业本身,对于主营业务为免疫细胞治疗的生物医药企业,可以分生物制品和技术两个方面来考察企业的业务模式,且均应根据政策监管动态审慎核查企业业务的合法合规性及业务模式的可持续发展性。
