类器官——研究疾病的利器,再生医学的未来
Nature Methods 如此评价类器官(Organoids)技术:利用干细胞直接诱导生成三维组织模型,为人类生物学研究提供了强大的方法。
 干细胞研究已经成为了生物学研究的一个重要分支,而研究干细胞的目的之一是帮助我们更好的理解生命发生的各个维度。
干细胞研究已经成为了生物学研究的一个重要分支,而研究干细胞的目的之一是帮助我们更好的理解生命发生的各个维度。
随着生命科学的发展,人类想要更好地了解自己,攻克各种疾病,已不能仅仅满足于在动物模型上试验进行疾病研究和药物开发,复制和重建人类器官成为科学家们想要迫切解决的问题之一——于是,类器官诞生了。
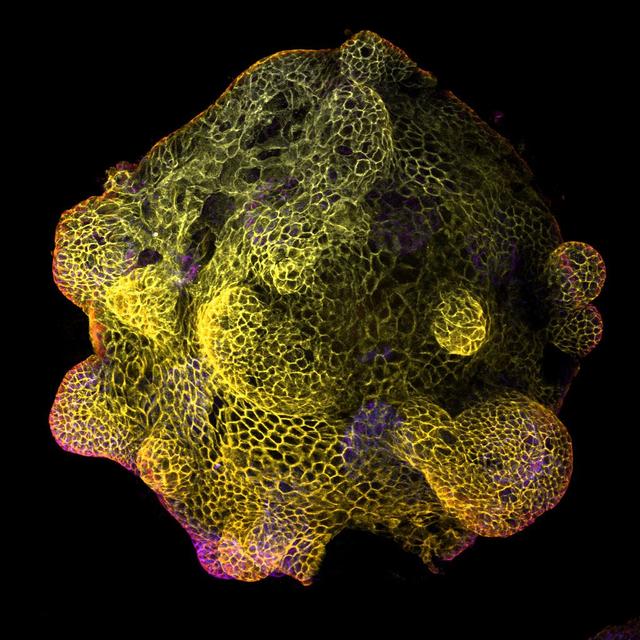
类器官的基本概念
顾名思义,类器官(Organoids)即是指它类似于组织器官。它是一种基于3D体外细胞培养系统建立的,包含多种细胞类型,与体内的来源组织或器官高度相似的一种“微器官”模型。
类器官是神奇的“多面手”,它能够让我们更好地理解生物发育,同时帮助我们治愈疾病。有了类器官,研究人员可以深入观察人体的变化、检验药物的功能以及发展实验室层面的再生治疗法。因而在基础研究以及临床诊疗方面具有广阔的应用前景。
科学家Lancaster和Knoblich,这样定义类器官:
“器官特异性细胞的集合。这些细胞从干细胞或器官祖细胞发育而来,并能以与体内相似的方式经细胞分序(cell sorting out)和空间限制性的系别分化而实现自我组建”。
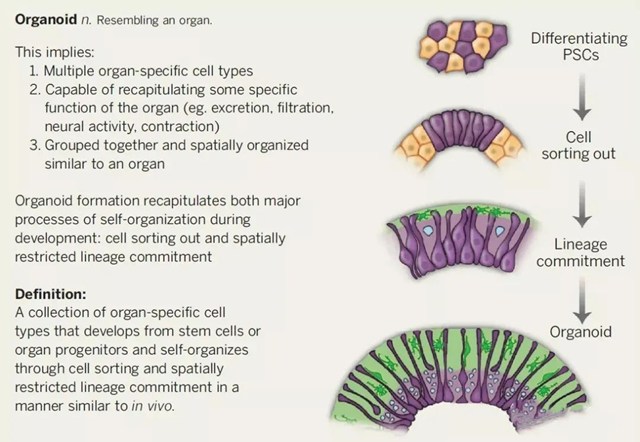
基于这一定义,可以发现类器官具备这样几个特征:
l 必须包含一种以上与来源器官相同的细胞类型;
l 应该表现出来源器官所特有的一些功能;
l 细胞的组织方式应当与来源器官相似。
这项技术始于2009年,荷兰Hubrecht研究所的Hans Clevers团队成功的将成体干细胞培养成为小肠的隐窝和绒毛结构。
2011年,该领域再次获得突破,日本RIKEN发育生物学中心的研究人员将干细胞构建成为视杯结构。
2013年,来自日本、德国、美国的科研人员分别构建出肝芽、迷你肾和微型大脑,使该领域获得了国际的广泛关注,并被Science评选为2013年的十大突破。
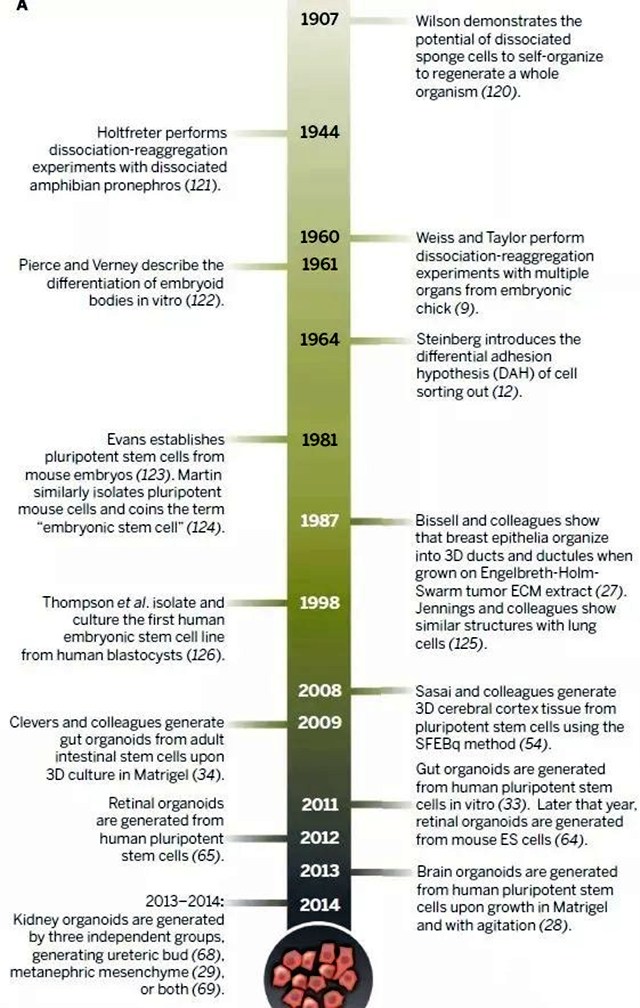
近年来,该技术不仅在更多种类的组织器官构建中获得了突破,在疾病研究、药物筛选、药物毒理测试等领域也展现出作为组织模型的应用潜力。此次,Nature Methods将其确定为年度技术,再次凸显了该技术的巨大发展潜力,未来该领域有望引起全球更大范围的研究热潮。
从干细胞到类器官,实现2D到3D细胞培养质的飞跃
传统的二维 (2D) 肿瘤细胞系培养和动物人源性肿瘤异种移植物 (PDTXs) 长期以来一直被用作肿瘤模型,并为癌症研究做出了巨大贡献。然而,各种缺点阻碍了这些模型的临床应用,比如二维细胞培养体系不具备免疫细胞、微环境、间质成分和器官特异性的功能。而类器官的基因修饰可实现在接近生理环境的情况下进行疾病建模,此外,类器官可以从患者来源的健康组织和肿瘤组织中迅速培育,从而使患者特异性药物检测和个性化治疗方案的开发成为可能。另外,类器官维护便利,具有整合免疫细胞的可能性,易进行基因改造 (遗传性肿瘤建模),支持匹配对照的研究,并可用于高通量药物筛选和生物库的建设。因此,从2D细胞培养到3D细胞培养,类细胞实现的是质的飞跃。
干细胞与胃底类器官
2017年1月4日,美国某儿童医院医疗中心的研究人员成功利用人类多能干细胞培育出能产生胃酸和消化酶的胃底类器官。
研究人员发现了在小鼠胚胎中调控胃细胞发育的重要信号通路Wnt/β-catenin,并通过在人类多能干细胞(hPSC)来源的前肠祖细胞中激活该通路,实现了人类胃底类器官(hFGOs)的构建。同时,利用hFGO,研究人员还识别出调控表皮形态发生及胃底主细胞和壁细胞分化的关键分子信号。
干细胞与功能性肠道类器官
2017年1月12日,日本医疗研究中心的研究人员利用人类多能干细胞培育出功能性肠类器官。
该肠类器官含有源自3个胚层的肠细胞:肠上皮细胞、杯状细胞、潘氏细胞和肠内分泌细胞,并具有肠道功能,包括肽的吸收,以及响应组胺和抗胆碱能药物的刺激而表现出肠蠕动。
干细胞与角膜类器官
2017年1月27日,美国的研究人员利用人类诱导多能干细胞成功培养出角膜类器官。该角膜类器官具有与正常发育的角膜同样的特征,包含三种不同的细胞类型:上皮细胞、基质细胞和内皮细胞。

干细胞与肺脏类器官
2017年4月24日,美国哥伦比亚的研究人员利用人多能干细胞生成了模拟肺部结构和功能的类器官,包含分支气道和肺泡结构,且该分支结构达到了人类妊娠中期的发育水平。
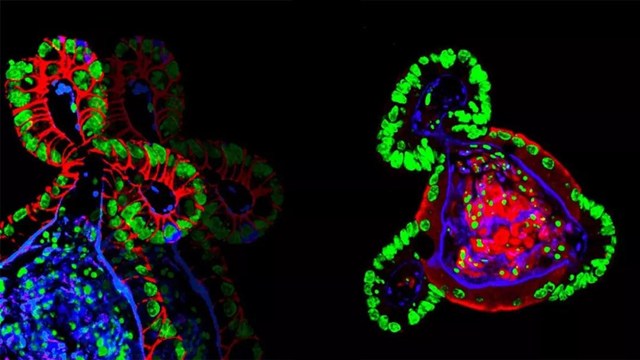
干细胞与结肠类器官
2017年6月19日,美国威尔的研究人员利用家族性腺瘤性息肉病(FAP)患者皮肤成纤维细胞的诱导多能干细胞构建了结肠类器官。
研究证实,构建的结肠类器官具有结肠组织的生物学特征,包含干细胞、短期扩增细胞、分化细胞等。研究人员进一步证实了其在结直肠癌靶向药物开发中的应用潜力。
2017年7月6日,美国的研究人员利用人类多能干细胞培育出结肠类器官。研究人员基于动物模型展开分子和遗传学筛查,并结合多个数据库,发现BMP信号对肠上皮细胞发挥调控作用。通过短暂激活BMP信号,成功促使干细胞发育形成结肠类器官(HCO)。移植到实验鼠体内发育6到10周后,这一类器官的形态、结构、分子和细胞特性等都与人类结肠相似。
 2017年10月13日,荷兰乌的研究人员利用CRISPR-Cas9技术敲除了人类结肠类器官中的关键DNA修复基因,并进行延迟亚克隆(delayed sub-cloning)和全基因组测序,准确地模拟了错配修复缺陷型结直肠癌中观察到的突变,为癌症突变研究提供了有效的工具。
2017年10月13日,荷兰乌的研究人员利用CRISPR-Cas9技术敲除了人类结肠类器官中的关键DNA修复基因,并进行延迟亚克隆(delayed sub-cloning)和全基因组测序,准确地模拟了错配修复缺陷型结直肠癌中观察到的突变,为癌症突变研究提供了有效的工具。
类器官的治疗潜能研究
类器官的研究主要集中于疾病模型,如发育相关问题,遗传疾病,肿瘤癌症等。
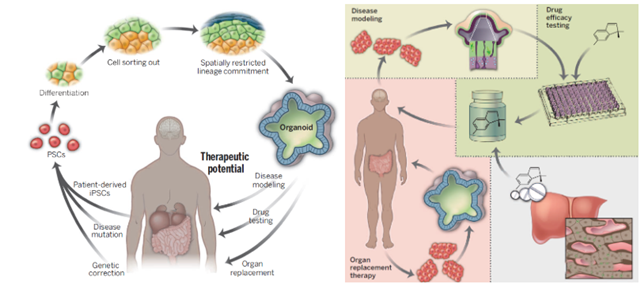
通过使用患者的iPSCs建立有价值的疾病模型,并在体外模拟重现病人疾病模型;同时,类器官的建立可以对药物药效和毒性进行更有效、更真实的检测。由于类器官可以直接由人类iPSCs直接培养生成,相较动物模型在很大程度上避免了因动物和人类细胞间的差异而导致的检测结果不一致。
不过,目前在体外构建组织和器官仍是一大挑战——希望类器官的建立及研究可以帮助人类在这方面更进一步。
类器官在癌症治疗中的研究
目前,类器官多用于肿瘤癌症的研究中,主要包括有药效毒理测试、类器官“生物银行”和重演肿瘤形成。
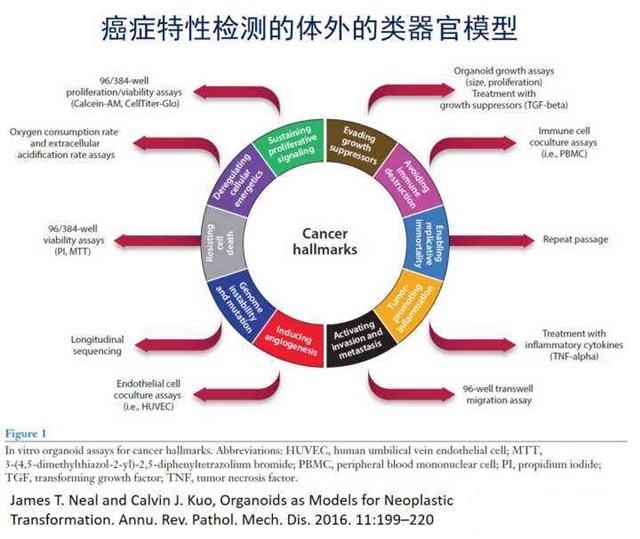
药效和毒理测试:类器官的培养可用于临床前癌症的治疗检测,药物药效和毒性测试。在转化医学的研究中,类器官逐渐走向肿瘤癌症基础研究和临床治疗的中央舞台。
类器官“生物银行”:建立了活体类器官“生物银行”,肿瘤类类器官生物库使生理学相关的药物筛选成为可能,也可用于确定类器官是否对个体患者的药物反应,具有预测价值。
重演肿瘤形成:类器官的培养和建立,可用于研究肿瘤生成过程中的突变过程,比如说,通过从同一肿瘤的不同区域培养无性繁殖的类细胞器,可以用来研究肿瘤内部的异质性。
未来可期,前路漫漫
作为一项重大的技术突破,迄今,多种来源的类器官业已面世,包括脑、肠道、胃、舌、甲状腺、胸腺、睾丸、肝脏、胰腺、皮肤、肺、肾、心脏及视网膜等,类器官允许在一个模拟内源性细胞组织和器官结构的环境中进行组织生物学、发育、再生、疾病建模 (包括癌症研究)、器官移植技术改良、药物发现/疗效评估以及毒理学的研究。因此,类器官目前已被公认为生物研究的重要工具,并具有重要的临床应用价值。
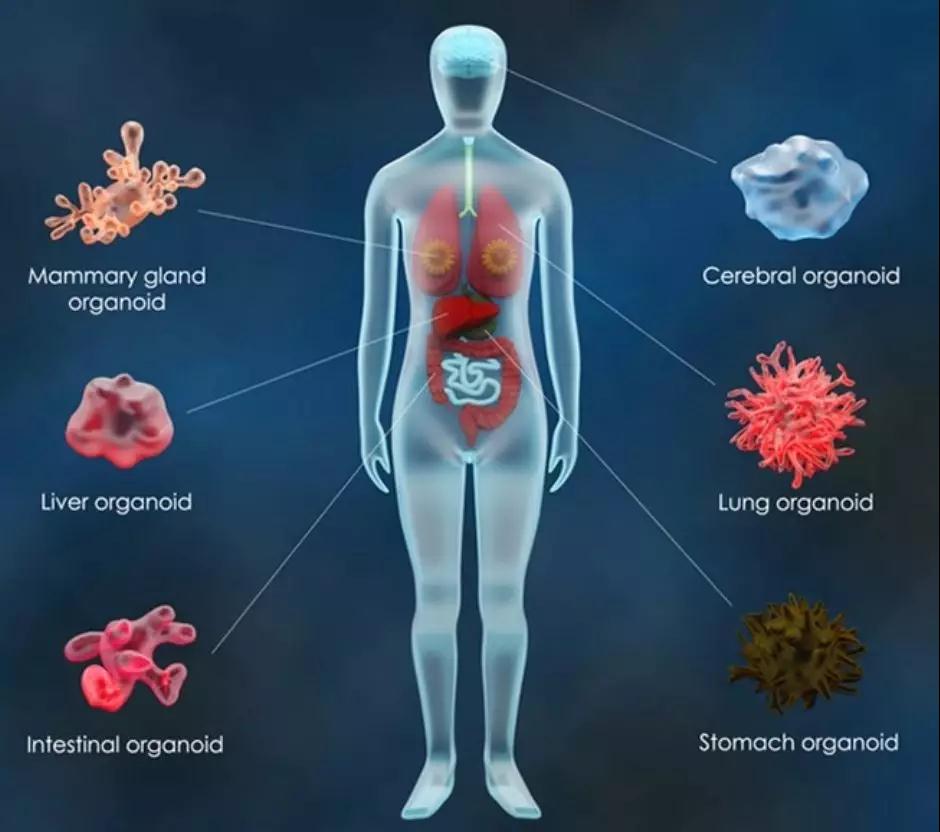
类器官领域的研究仍在起步阶段,随着相关研究不断取得进展,人们不免对它的前景产生了更多期待。不过,它也存在局限:
相较于癌症细胞系的培养,类器官的体外培养需要消耗更多的时间和资源;
相较于人体正常组织器官的生理环境,类器官缺乏结缔组织,血管和免疫细胞的微环境;
在类器官的培养过程中,一些体外因素如小鼠来源的细胞外基质(ECM)替代物、胎牛血清等都可能会影响一些实验结果,比如药物筛选实验等;
来自晚期癌症的类器官生长速度通常比来自正常上皮的类器官生长速度慢,这可能会导致肿瘤类器官过度生长通过混入正常上皮细胞来源的类器官。
未来,这些局限性是否能够实现突破,使得类器官发挥出更大的作用?让我们拭目以待。
